PEMBENTUKAN DAN SIFAT SIFAT ASAM KARBOKSILAT
Manufaktur
Asam
karboksilat dibentuk oleh oksidasi dari alkohol primer , dengan aldehida
terjadi sebagai tahap peralihan . Zat pengoksidasi yang sesuai adalah,
misalnya, kalium permanganat , kromium trioksida, asam nitrat atau kalium
dikromat .
Asam
karboksilat
Asam
karboksilat memiliki struktur yang sangat berbeda karena merupakan turunan dari
hidrokarbon yang sesuai. Perwakilan yang paling terkenal tentunya adalah asam
alkanoat, tetapi asam karboksilat tak jenuh atau senyawa aromatik juga
termasuk. Ciri struktural yang umum adalah gugus karboksil, yang memengaruhi
sifat semua asam karboksilat.
komponen
alami makanan, asam organik bertanggung jawab atas rasa asam yang kuat. Di
alam, bagaimanapun, mereka juga memainkan peran utama dalam proses metabolisme
sebagai produk antara atau akhir.
Asam
karboksilat dicirikan oleh gugus fungsi khusus - gugus karboksil .
Asam
karboksilat
Asam
karboksilat termasuk dalam kimia organik dan bisa sangat asam.
Asam
karboksilat adalah zat organik yang terikat dengan satu atau lebih gugus
karboksil (-COOH). The gugus karboksil
dapat karena itu juga disebut sebagai kelompok fungsional dari asam
karboksilat. Pada gugus karboksil , ion hidroksida (-OH - ) juga dapat
digantikan oleh atom lain, seperti klor (Cl). Ini kemudian mengarah pada apa
yang disebut turunan asam karboksilat , yang termasuk dalam ester asam
karboksilat, amida asam karboksilat atau asam karboksilat halida.
asam karboksilat terdiri dari radikal (R) dan
gugus karboksil (-COOH) . Sebagian besar waktu, sisanya adalah hubungan antara
hidrogen dan karbon, itulah sebabnya ia juga dapat disebut sebagai gugus alkil
. Struktur kimia sisanya menentukan apakah itu asam karboksilat aromatik , heterosiklik
atau alifatik . Senyawa aromatik memiliki sistem cincin yang dibangun menurut
aturan Huckel. Alifatikadalah ikatan yang tersusun dari atom karbon dan
hidrogen, tetapi tidak bersifat aromatik. Asam alkanoat, asam alkenoat dan asam
alkinoat akan menjadi contoh asam karboksilat alifatik. Dalam kasus molekul
heterosiklik , ada juga pembentukan cincin, tetapi dengan setidaknya dua jenis
atom yang berbeda.
Anda
juga dapat membagi asam karboksilat menjadi asam jenuh dan asam tak jenuh .
Dalam kasus senyawa jenuh, karbon sisanya hanya memiliki ikatan tunggal dengan
atom lainnya. Yang tak jenuh memiliki dua atau ikatan rangkap tiga . Asam
alkanoat adalah asam jenuh, sedangkan asam alkinoat adalah senyawa tak jenuh.
Anda
selanjutnya dapat membagi rumus struktur menurut jumlah gugus karboksil pada
molekul. Perbedaan dibuat di sini antara asam monokarboksilat dengan satu, asam
dikarboksilat dengan dua dan asam trikarboksilat dengan tiga gugus karboksil.
Selain
itu, pembedaan juga dapat dibuat menurut kelompok fungsionalnya. Jika asam
karboksilat memiliki beberapa gugus fungsi yang berbeda, perbedaan dibuat
antara asam hidroksikarboksilat , asam ketokarboksilat , dan asam amino . Asam
hidroksikarboksilat memiliki gugus karboksi dan gugus hidroksil. Asam keto juga
memiliki gugus keto. Keton memiliki satu atom karbon (C) dan satu atom oksigen
berikatan ganda (O). Dengan asam amino tersebut ada juga gugus yang mengandung
nitrogen (N).
Asam
karboksilat vinilog
Dalam
kimia organik, prinsip vinilogi dipahami sebagai suatu senyawa dengan efek
mesomer juga mempertahankan hal ini, meskipun dipisahkan oleh satu atau lebih
ikatan rangkap.
Prinsip
ini juga berlaku untuk asam karboksilat , lebih tepatnya untuk karboksilasi.
Anion dari gugus karboksilat distabilkan oleh efek mesomerik. Jika Anda
sekarang menambahkan satu atau lebih ikatan rangkap, seperti pada gambar di atas, mesomerisme dipertahankan dan molekul selanjutnya distabilkan oleh
efeknya.
Asam
alkanoat
Asam
alkanoat adalah bentuk paling sederhana dari asam karboksilat. Mereka terdiri
dari radikal alkil dan gugus karboksi. Rumus umumnya adalah: C n H 2n + 1 di
mana n berarti bilangan apa pun.
Asam
alkanoat juga termasuk dalam asam monokarboksilat , karena hanya terdiri dari
satu gugus karboksil.
Sifat
asam karboksilat
Dalam
artikel tentang kelompok karboksil ,dijelaskan dengan tepat cara kerja pembelahan proton. juga akan
menjelaskan dengan efek mesomeric , yang sebagian besar bertanggung jawab untuk
membelah off, ada. Hubungan ini penting karena sifat asam karboksilat tanpa
gugus fungsi lain terutama ditentukan oleh gugus karboksil.
Selain
itu, gugus karboksil bertanggung jawab atas keasaman asam karboksilat. Semakin
pendek radikal alkil, semakin kuat asamnya. Namun, jika sisa lebih lama,
kekuatan asam juga berkurang, karena residu alkil yang lebih lama dan lebih
lama pada gugus karboksil membatalkan efek polar . kita dapat melakukan ini
secara terukur dengan nilai pKs .
Namun,
gugus alkil menentukan sifat fisik senyawa, seperti suhu didih dan suhu leleh.
Residu rantai pendek memiliki titik didih yang relatif tinggi dan berbau
menyengat. Contohnya adalah asam format atau asam butirat.
Sifat
akhir dari asam karboksilat adalah bahwa mereka dapat membentuk ikatan antara
satu sama lain dengan sangat baik. Dalam gugus karboksil terdapat atom hidrogen
bermuatan positif dan atom oksigen terpolarisasi negatif, yang dapat membentuk
ikatan hidrogen dengan gugus karboksil lain . Dimers terbentuk. Ini adalah
molekul yang terdiri dari dua unit identik, monomer.
Asam
karboksilat, ikatan hidrogen, monomer, gugus karboksil
Reaksi
asam karboksilat
Secara
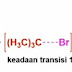
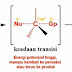
umum, Anda dapat mengatakan bahwa asam karboksilat sangat mudah diakses oleh
serangan nukleofilik . Ini karena atom karbon pusat memiliki muatan parsial
positif karena tetangganya, atom oksigen yang sangat menarik elektron. Serangan
nukleofilik ini dapat dikatalisasi, artinya dipromosikan, oleh asam.
Dalam
konteks ini, dua reaksi penting yang melibatkan asam karboksilat adalah
esterifikasi dan dehidrasi .
Selama
esterifikasi, gugus karboksil bereaksi dengan gugus OH dari alkohol. Ester
terbentuk dan air dipisahkan.
Esterifikasi,
asam karboksilat, dehidrasi, gugus OH, alkohol
Asam
karboksilat supurasi
Ester
yang terbentuk di sisi kanan juga disebut sebagai ester asam karboksilat .
Selain itu, reaksi balik yang sesuai terjadi pada waktu yang sama. Air dapat
menyerang ester secara nukleofilik. Dengan cara ini asam asli dapat dibentuk
kembali.
Dua
asam karboksilat juga dapat bereaksi satu sama lain dengan eliminasi
antarmolekul air . Penghapusan air disebut sebagai dehidrasi . Reaksi ini
menciptakan apa yang disebut anhibrid asam karboksilat. Ini adalah asam yang
mengandung oksigen.
Dehidrasi,
asam karboksilat, eliminasi antarmolekul air, eliminasi, hibrid asam
karboksilat
Dehidrasi
asam karboksilat
Reaksi
hanya berlangsung pada suhu yang lebih tinggi.
Seri
homolog asam karboksilat
Seri
homolog menggambarkan serangkaian zat yang semuanya dapat diwakili oleh jumlah
yang sama susu formula. Jadi mereka hanya berbeda dalam jumlah atomnya.
PERMASALAHAN:
1. Pada asam karboksilat vinilog, Anion dari gugus karboksilat distabilkan oleh efek mesomerik. Apakah ada kemungkinan yang menempatkan anion dari gugus karboksilat tidak bisa distabilkan oleh efek mesomerik?. dan apakah yang akan terjadi?
2. jika semakin panjang rantai alkil, kekuatan asam juga berkurang. dimanakah letak berkurangnya kekuatan asam? jelaskan
3. Dua asam karboksilat juga dapat bereaksi satu sama lain dengan eliminasi antarmolekul air . dapatkah pada reaksi ini dilakukan dengan cara subtitusi? apakah akan memberikan hasil yang berbeda?