Mekanisme
reaksi E1
Untuk
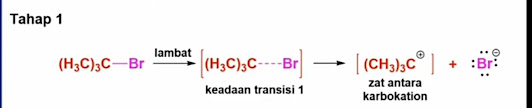
mekanisme reaksi E1, tahap yang pertama yaitu ionisasi alkil atau substrat.
Sebagai contoh Terbutil bromida
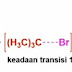
Tahap ini adalah tahap yang lambat karena membutuhkan energi tambahan untuk memecah ikatan antara subtrat dengan gugus perginya menjadi sebuah zat antara karbokaiton dan sebelumnya harus mencapai keadaan transisi. Jadi, karena tahap pertama ini berjalan lambat maka tahap pertama ini adalah tahap penentu laju dari keseluruhan reaksinya. Suatu reaksi e1 menunjukkan kinetika orde pertama karena dalam keadaan transisinya diperlihatkan molekul substratnya saja. Tidak ada molekul nukleofiliknya. Itulah mengapa reaksi E1 termasuk reaksi first order. Laju reaksi E1 hanya ergantung pada konsentrasi substratnya saja atau konsentrasi alkil halidanya karena hanya melibatkan satu molekul saja dalam keadaan transisinya.
Tahap
yang kedua pada reaksi eliminasi basa (H2O) merebut proton dari
karbokation yang berdekatan. Elektron ikatan sigma karbon hidrogen bergeser ke
arah muatan positif atau ke karbon positif.jadi karbon mengalami hibridisasi
dari keadaan sp3 ke sp2. Bisa kita lihat CH3 dalam keadaan
hibridisasi sp3 kemudian saat hidrogennya diambil dalam keadaan transisi
diperlihatkan terjadi rehibridisasi dimana CH3 disini berubah
menjadi hibridisasi sp2 dan terbentuklah produk 2 metil propena.



Baiklah saya Binro Naibaho dengan NIM A1C119049 akan menjawab permasalahan nomor 3.jika direaksikan dengan basa kuat Reaksi eliminasi alkil halida dapat terjadi jika direaksikan dengan suatu basa kuat. Akibatnya adalah molekul alkil halida kehilangan satu atom H dan halidanya, namun tidak digantikan oleh gugus penyerang. Oleh karena yang dibuang adalah H dan X(halida), reaksi eliminasi halida sering juga disebut reaksi dehidrohalogenasi (reaksi penghilangan hidrogen dan halogen).
BalasHapusKomentar ini telah dihapus oleh pengarang.
BalasHapusBaiklah, saya Riska Indriyani NIM A1C119091 akan menjawab permasalahan nomor 1.
BalasHapusAdapun E1 terdapat tahap ionisasi dan protonisasi dikarenakan E1 ini berfokus pada penentuan laju reaksi pada keadaan transisi. Adapun dilakukan dua tahap karena reaksi ionisasi merupakan tahap spontan membentuk intermediet karbokation sehingga akan ada proton-proton yang tertarik pada atom karbokation adapun itu akan termasuk kedalam tahap protonisasi. Jadi kedua tahap tersebut saling berkaitan dalam satu reaksi namun untuk mempermudah jalan reaksinya makan dibedakan menjadi dua tahap yang masih berhubungan satu sama lainnya.