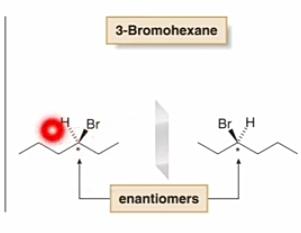
Mekanisme Reaksi Subtitusi Nukleofilik Unimolekuler
Secara umum reaksi Sn1 yang nukleofiliknya berupa basa yang sangat lemah(seperti H2O dan C2H3OH) direaksikan dengan alkil halida tersier terbentuk produk subtitusi, bersamaan dengan produk eliminasi. Karena H2O dan C2H3OH juga digunakan sebagai pelarut.
Ketika alkil harida ini kita reaksikan .
Tahap tahap mekanisme reaksi Sn1
· Tahap 1 : ionisasi
· Tahap 2 : kombinasi dengan nukleofilik
· Tahap 3 : reaksi asam basa
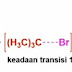
Contoh mekanisme reaksi Sn1 adalah tert-butilbromida (CH3)3CBr yang direaksikan dengan air atau etanol.
Pada saat tahap 1 Br perlahan melepaskan diri dari substratnya, jadi butuh energi. Semakin besar energi, semakin cepat laju reaksinya. Jadi untuk memutuskan gugus pergi dengan karbon yang ada pada substrat itu dibutuhkan energi tambahan agar alkil halida tersier ini bisa melepaskan atau mematahkan ikatan antara karbon dengan gugus perginya. Setelah lepas, maka dihasilkan suatu zat antara karbokation dan anion gugus pergi. Zat antara adalah suatu produk dimana bersifat sangat reaktif. Karena hal itu, zat antara dapat bereaksi dengan molekul atau nukleofilik apa saja maskipun nukleofiliknya sangat lemah.
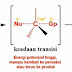
Pada tahap 2 diperlihatkan zat antara karbokation itu mampu bereaksi dengan pelarutnya(H2O) dan reaksinya berjalan dengan sangat cepat yang disebabkan oleh zat antara karbokation yang sangat reaktif tadi. Dari reaksi ini, menghasilkan suatu keadaan transisi kedua dimana terdapat ikatan baru antara karbon dengan oksigen yang kemudian dihasilkan suatu produk antara tert butil alkohol yang memiliki kelebihan hidrogen sehingga menghasilkan suatu oksigen yang bermuatan positif. Pada tahap ini sudah bisa disebut dengan tahap ion Sn1, namun karena hasil dari produknya masih mengandung proton, maka dilakukan tahap 3 dengan menambahkan suatu reaksi yaitu tahap asam-basa.
Pada tahap ke 3 ini tertbutil alkohol berperan sebagai asam sedangkan H2O sebagai basa dimana reaksinya adalah reaksi kesetimbangan menghasilkan tert butil alkohol dan asam H3O+.
Permasalahan:
1. 1. Dijelaskan bahwa reaksi diatas memiliki zat antara karbokation yang sangat reaktif yang dapat bereaksi dengan nukleofilik apa saja. Nah, bagaimana jika pada suatu reaksi kita dapati zat antara karbokation yang kurang reaktif, bagaimana dengan jalan reaksinya? Apakah zat antara karbokation tersebut punya batasan untuk bereaksi dengan nukleofiliknya?
2. 2. pada tahap 2 itu sebenarnya sudah bisa dikatakan mekanisme reaksi Sn1. Mengapa tahap 3 itu perlu dilakukan atau hanya sekedar untuk menghilangkan kandungan proton pada produk? Apakah jika produk mengandung proton atau tidak akan berpengaruh besar pada reaksi diatas?
3. Pada saat keadaan transisi 1 saat terbentuknya zat antara, apakah ada perubahan sifat spesifik yang terjadi padat-butil bromida itu sendiri?