Pada blog kali ini kita akan membahas mengenai reaksi reaksi dasar organik yang merupakan bahasan mata kuliah kimia organik II. Sebelum kita membahas tentang reaksi reaksi dasar organik, ada 3 hal dasar yang perlu kita pahami terlebih dahulu, yaitu:
1. Gugus fungsi
2. Bagian yang kaya/miskin akan elektron
3. Ikatan yang mudah putus
Setelah memahami ketiga hal dasar diatas, kini kita akan membahas terlebih dahulu bagaimana cara penulisan persmaan reaksi organik itu sendiri.
1. Yang pertama, reagen ditulis di
sebelah kiri panah reaksi
2.
Produk
dituliskan disebelah kanan panah reaksi
3. Panah reaksi dituliskan diantara
reagen dan produk
4. Diatas ataupun dibawah panah reaksi
dapat dituliskan beberapa hal seperti reagen, solven, ataupun parameter reaksi(suhu,
tekanan, cahaya, dll).
Jika terdapat 2 reaksi yang
berlangsung, maka reaksi pertama dapat diletakkan di atas panah reaksi dan
reaksi kedua dapat diletakkan di bawah panah reaksi. Jika ada produk samping
berupa produk organik, biasanya tidak ditulis.
MACAM-MACAM REAKSI ORGANIK
Ada 3 macam reaksi organik secara
umum yaitu, reaksi subtitusi, reaksi adisi dan reaksi eliminasi. Sebenarnya
masih adalagi reaksi organik lainnya, namun reaksi yang lain tersebut merupakan
reaksi kembangan.
Baiklah, mari kita bahas 3 macam
reaksi diatas.
1.
Reaksi Subtitusi
Dimana suatu atom/grup digantikan dengan atom/grup lain disebut reaksi subtitusi. Pada umumnya, reaksi subtitusi menghasilkan 2 produk.
Contoh dari reaksi subtitusi adalah CH3I bereaksi dengan Cl- dan hasil akhirnya posisi I digantikan dengn Cl hasilnya adaah CH3-Cl.
2.
Reaksi Adisi
Reaksi antara 2 reaktan
yang membentuk 1 jenis produk, tanpa ada atom yang tersiksa. Reaksi ini
berlangsung dengan pemutusan satu ikatan π(phi)
dan pembentukan ikatan σ(sigma). Sebagai contoh 2 ikatan ini bereaksi antasa
etilen dan HBr dan hasilnya membentuk produk dimana Hbrnya masuk kedalam
molekul tersebut sehingga tidak ada lagi atom yang tersisa. Dan ikatan π nya
terputus, dengan hasil akhirnya adalah ikatan σ.
3.
Reaksi Eliminasi
Reaksi pengeluaran 2 atom/grup dari molekul disebut reaksi eliminasi. Reaksi ini berlangsung dengan pembentukan ikatan π.
Sebagai
contoh atom H dan Br dari bromo alkana ini dapat keluar dari molekul ini dan
membentuk suatu alkena dimana ada ikatan π
MEKANISME REAKSI
Ada 2 tahap penting dalam mekanisme reaksi, yaitu tahap Bond Breaking atau pemutusan ikatan dan Bond Making atau pembentukan ikatan. Begitu juga dengan pembentukan ikatan yaitu reaksi radikal dan reaksi polar.
Pemutusan ikatan dapat terjadi melalui 2 cara.
Cara pemutusan pertama : Homolityc Cleavage(pembelahan homolitik)
Homolityc Cleavage(pembelahan homolitik) adalah cara yang pertama. Pada pembelahan homolitik, elektron akan dibagi secara merata kemasing masing atom dan perpindahan elektronnya akan ditandai dengan panah setengah kepala (fishhook). Dan hasil pembagian elektron yang merata ini akan menghasilkan atom atom yang radikal.
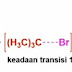
Cara pemutusan kedua : Heterolityc Cleavage(pembelahan heterolitik)
Pada pembelahan cara kedua, pembagian elektron tidak merata, sebagai contoh semua elektron akan berpindah keatom b dan ditandai dengan panah reaksi kepala penuh. Hasil pembelahan heterolitik ini adalah atom yang bermuatan positif, jika tersebut adalah karbon maka disebut dengan karbokation. Dan yang bermuatan negatif serta jika merupakan karbon maka disebut karbanion. Intermediet karbokation dan karbanion itulah yang akan berlanjut ke reaksi polar.
PEMBENTUKAN
IKATAN
Pada pembentukan ikatan, berlangsung dengan dua cara yang caranya berbeda.
1. Reaksi Radikal
Dimana terdapat 2 ataom(A dan B) yang masing-masingnya adalah radikal dan membentuk ikatan disebut reaksi radikal.
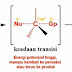
2. Reaksi Polar
Dimana ada nuklofil dan elektrofil dan dapat membentuk suatu ikatan disebut reaksi polar.
3. Bagaimana jika pada reaksi radikal terdpat lebih dari 2 atom? Dan apa yang akan terjadi?








Saya Lara Prastica NIM (A1C119045) akan menjawab pertanyaan nomor 1, iya bisa,
BalasHapussaat senyawa di substitusi, lalu hasil dari substitusi itu akan dieliminasi, nah yg di eliminasi atau yg dikeluarkan harus zat seperti H2 dikeluarkan karena ingin menjadi ikatan jenuh atau mengalami dehidrogenasi ,H2O dikeluarkan saat mengalami dehidrasi ,halogen dikeluarkan karena mengalami dehalogenasi, dan HX dikeluarkan pada saat ditambahkan dengan basa mengalami dehidrogenasi.
Terimakasih
Saya Rosa Uly Jayanti, NIM A1C119022 saya akan mencoba menjawwb permasalahan nomor 2
BalasHapusPaf
Pada Pembelahan homolitik adalah pembelahan yang pembagian elektronnya sudah pasti merata. Karena hasil pembagian elektron yang merata ini akan menghasilkan atom atom radikal. Jadi kemungkinan tidak akan terjadi pembagian elektron yang tidak merata pada pembelahan homolitik.
Terimakasih
Baiklah saya Grace Manik, NIM A1C119087, akan mencoba menjawab permasalahan nomor 3
BalasHapusJika pada reaksi radikal terdapat lebih dari 2 atom, kita misalkan 3 atom. Maka yang akan terjadi adalah ketiga atom tersebut akan bersaing dalam membentuk suatu ikatan.