Kompetisi SN 1
/ E1
Perbedaan mendasar antara kompetisi
S N 1 / E1 dan kompetisi S N 2 / E2
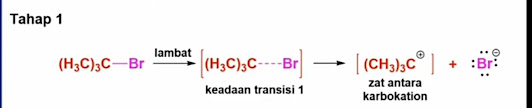
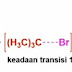
ada pada langkah mekanistik pertama, atau dalam pembentukan ion karbanium , yang sama sekali
identik dalam eliminasi E1 dan reaksi S N 1
. Jadi, pada langkah mekanis pertama reaksi E1 dan S N 1
jelas tidak bersaing. Persaingan muncul dari alternatif mekanis yang
mengikuti langkah pertama. Sama seperti dalam kompetisi S N 2
/ E2, nukleofil (basa) di S NPersaingan 1 / E1 pada dasarnya
bersifat bifungsional - yaitu, dapat mengabstraksi proton β dari ion karbenium
dalam eliminasi E1, atau dapat secara langsung menyerang karbon α dari ion
karbenium dalam reaksi S N 1.
Berbeda dengan kompetisi S N 2
/ E2, laju reaksi ketergantungan E1 dan S N 1 pada struktur
substrat tidak bertentangan, tetapi sejenis . Reaksi S N 1,
serta eliminasi E1, berlangsung sangat lambat dengan senyawa heteroalkil
primer, sehingga mereka biasanya sepenuhnya dilampaui oleh mekanisme yang sesuai (S N 2 /
E2). Berbeda dengan hal tersebut, dalam hubungannya dengan senyawa
heteroalkil tersier, reaksi unimolekuler (S N 1 / E1)
berjalan lebih cepat dibandingkan dengan reaksi bimolekuler (S N 2
/ E2).
Langkah tingkat-menentukan dari E1 dan S N 1
reaksi, pembentukan ion karbenium, bertanggung jawab untuk ketergantungan sama
diarahkan laju reaksi mereka pada struktur substrat. Karena stabilisasi
muatan positif ion karbenium oleh substituen alkil, energi aktivasi dalam pembentukan ion karbenium tersier lebih
rendah daripada energi aktivasi sekunder, atau, khususnya, untuk ion karbenium
primer. Oleh karena itu, laju reaksi reaksi E1 dan S N 1
jauh lebih tinggi dengan senyawa heteroalkil tersier dibandingkan dengan
senyawa heteroalkil sekunder atau primer.
Dalam kompetisi S N 1 / E1, jalannya reaksi setelah pembentukan ion karbenium tergantung pada karakter kimia dari reagen yang menyerang. Apakah reagen bertindak sebagai basa dalam eliminasi E1 atau sebagai nukleofil dalam reaksi S N 1? Sebuah nukleofil yang baik dengan kebasaan relatif rendah nikmat S N 1 reaksi sementara nukleofil miskinlebih menyukai eliminasi E1. Dalam eliminasi E1, proton tidak perlu disarikan oleh nukleofil (basa) (miskin). Sebaliknya, itu juga dapat diterima oleh molekul pelarut. Pada prinsipnya, laju reaksi eliminasi E1 meningkat dengan meningkatnya kebasaan nukleofil. Namun, jika basis yang lebih kuat diterapkan, eliminasi E1 semakin digantikan oleh eliminasi E2. Oleh karena itu, eliminasi E1 biasanya terjadi hanya dengan nukleofil buruk yang memiliki kebasaan rendah, atau jika tidak ada nukleofil atau basa (selain pelarut). Dengan meningkatnya nukleofilisitas, reaksi S N 1 disukai, sedangkan eliminasi E1 lebih disukai dengan peningkatan basa.
Dalam hal ini, penerapan natrium sianida (NaCN) terutama menghasilkan reaksi S N 1, karena anion sianida adalah nukleofil yang baik dan basa lemah dan lunak. Selain itu, kebasaan anion sianida cukup rendah sehingga eliminasi E2 melalui abstraksi proton β oleh basa kuat pada awal reaksi tidak dapat terjadi.
Dengan tetrabutylammonium klorida dalam aseton E1, eliminasi terutama diamati (sekitar 96%). Anion klorida, serta aseton, adalah nukleofil yang buruk dan basa yang sangat lemah. Oleh karena itu, baik reaksi S N 1 melalui serangan nukleofilik pada ion karbenium tidak terjadi atau eliminasi E2 melalui abstraksi proton β oleh basa kuat pada tahap awal reaksi dapat berlangsung.
Pusat reaksi dalam keadaan transisi bipiramidal trigonal dari reaksi S N 2 membawa lima substituen, sedangkan karbon pusat dari keadaan transisi reaksi S N 1 hanya memiliki tiga substituen. Karena itu, interaksi sterik menjadi kurang penting dalam interaksi yang terakhir. Namun demikian, jelas terdapat interaksi sterik antara ion karbenium dan nukleofil yang menyerang dalam keadaan transisi reaksi S N 1. Ini lebih kuat dari pada eliminasi E1. Oleh karena itu, eliminasi E1 mungkin lebih disukai bila ion karbenium atau nukleofil mengandung substituen yang besar dan menuntut secara sterik.
Nukleofilisitas nukleofil ditentukan oleh parameter terkenal. Ini adalah kebasaan nukleofil dan keelektronegatifan atom yang menyerang, serta kebutuhan sterik substituen nukleofil. Namun, karena alasan yang disebutkan di atas, pengaruh interaksi sterik terhadap nukleofilisitas lebih kecil pada reaksi S N 1 daripada pada reaksi S N 2.
PERMASALAHAN:
1. Bagaimana proses terjadinya persaingan antara SN1 dan E1? apakah perbedaan atau faktor yang membuat kedua reaksi tersebut bersaing?
2. apakah eliminasi E1 atau reaksi S N 1 mengikuti pembentukan ion karbenium? dan apasaja yang menjadi parameternya?
3. reaksi mana yang lebih dominan saat persaingan sedang berlangsung?